
一、背景介绍
肝移植虽是终末期肝衰竭的金标准,但供体短缺促使探索替代疗法。现有组织工程策略(如微囊化、细胞片)难以模拟肝微环境且力学强度不足,限制长期疗效。3D生物打印通过精准排布细胞与生物材料,为构建可移植肝组织提供新思路。然而,现有研究多采用肝癌细胞系(如HepG2、HepaRG),其肝特异性功能不足限制了生物打印肝脏组织的功能,且单细胞打印细胞数量有限,细胞互作缺失导致功能衰退。
本研究提出创新策略:结合化学重编程来源的无基因修饰人多能干细胞(hCiPSCs)与球体生物打印技术。通过PDMS基透气微孔装置规模化培养高活性肝类器官(hCiPSC-HOs),并基于球体打印构建高密度肝组织模型(3DP-HOs)。相较于单细胞打印,球体打印保留类器官内细胞互作,显著提升肝功能基因(如ALB、CYP3A4)表达,其功能接近原代肝细胞(PHHs)。体内实验表明,3DP-HOs在小鼠肝衰竭模型中显著提高生存率,促进肝再生并缓解纤维化,且通过宿主血管网络实现长效氧供与代谢支持。该技术为肝再生医学提供了兼具功能性与稳定性的新型治疗策略。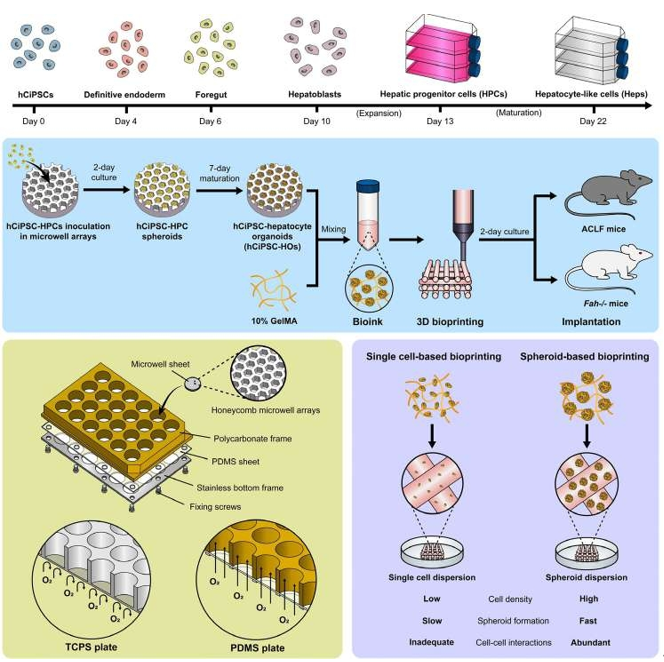
二、结果
2.1 利用透氧微孔装置制备高功能 hCiPSC-HOs
本研究基于透氧微孔装置实现功能性肝类器官(hCiPSC-HOs)的规模化制备。hCiPSC-HPCs(96% CK19/AFP双阳性)经微孔培养自组装为球体,其直径(约95 μm)与细胞活性(>90%,前6天)显著优于传统2D培养。功能分析显示,3D球体的白蛋白分泌(峰值9.68±0.65 μg/百万细胞/24 h)及尿素合成(214.40 ± 31.60 μg/百万细胞/24 h)于第7天达峰,功能指标接近原代人肝细胞(PHHs)。基因表达(HNF4A、CYP3A4等)与功能实验(ICG代谢、脂质代谢等)证实hCiPSC-HOs具备成熟肝细胞特性,并形成胆管样极性结构。该技术为构建生物打印肝模型提供了高活性功能单元。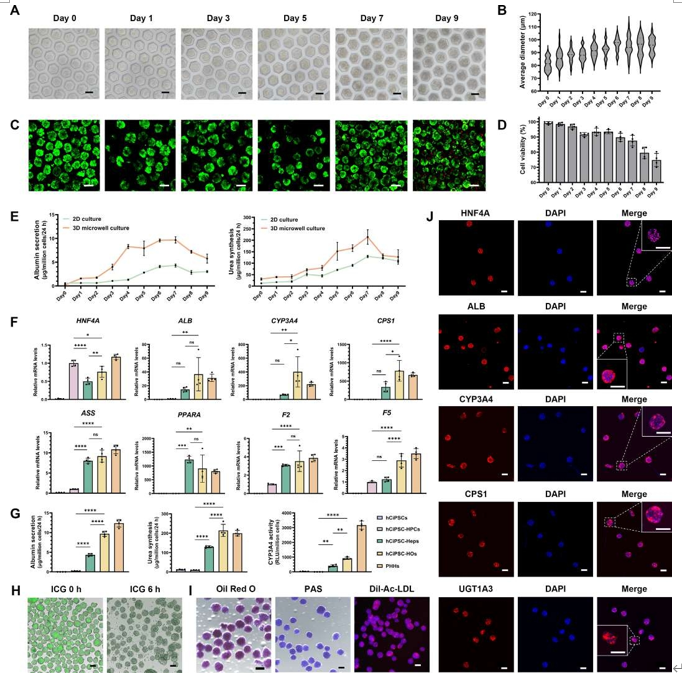
图3. 基于球体的生物打印肝组织模型确保了 hCiPSC-HOs 的高活性和生物功能。
2.3 RNA测序分析表明hCiPSC-HOs与3DP-HOs基因表达谱相似且肝功能增强
通过RNA测序比较多种细胞模型的基因表达特征,研究发现:hCiPSC-HOs与3DP-HOs在PCA和层次聚类中呈现高度相似性(图4A-B),证实生物打印过程未显著改变基因表达。差异分析显示,3DP-HOs较hCiPSC-HOs在胆汁分泌、细胞黏附和氧响应相关基因表达增强,但与PHHs相比,其免疫活性及细胞色素P450介导的药物代谢能力较弱,而胆固醇/脂肪酸代谢功能更强(图4A)。值得注意的是,hCiPSC-HOs和3DP-HOs的基因表达与PHHs的差异显著小于hCiPSC-Heps。进一步分析发现,hCiPSC-HOs较hCiPSC-Heps呈现肝脏功能基因上调(332个共同差异基因),尿素循环相关通路显著激活,同时肝祖细胞和炎症标志物下调(图4C-F)。热图显示3DP-HOs与hCiPSC-HOs在尿素循环和代谢转录因子表达上明显高于其他组,而肝祖细胞标志物表达更低(图4G-H)。GSEA证实hCiPSC-HOs在氨基酸分解代谢和PPAR信号通路上具有优势(图4I)。综上所述,hCiPSC-HOs经生物打印后仍维持优越的肝脏代谢功能,其成熟度显著优于hCiPSC-Heps。
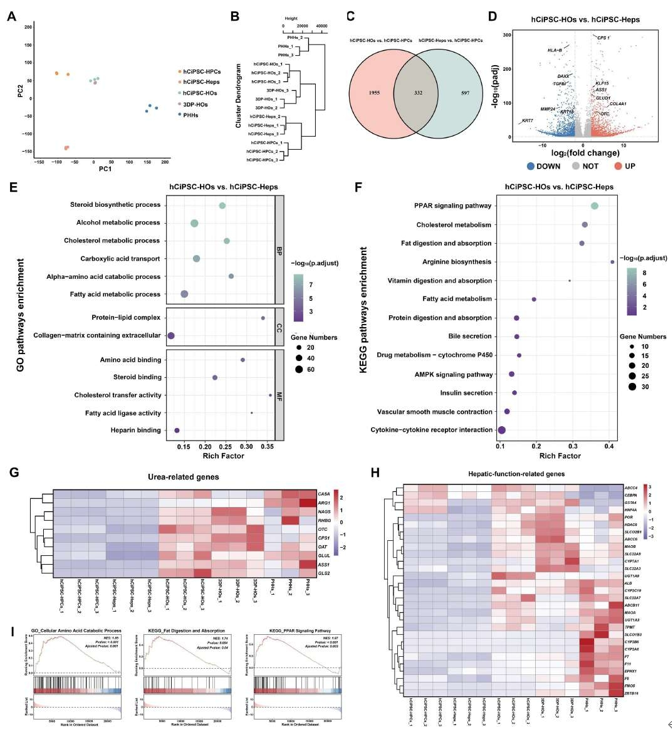
图 4. RNA测序分析显示hCiPSC-HOs与3DP-HOs基因表达谱相似且肝功能增强
2.4 3DP-HOs移植有效救治CCl4诱导的慢加急性肝衰竭小鼠
将3DP-HOs植入CCl₄诱导的急性慢加急性肝衰竭(ACLF)小鼠模型(图5A)后,治疗组7天生存率达85.7%,显著优于无细胞假手术组(0%)及空白组(0%)。植入肺癌细胞来源的3DP-A549组小鼠7天内全部死亡,证实3DP-HOs疗效具有细胞特异性。3DP-HOs组生存率与正常对照组无差异(图5B),且血清中人白蛋白(hALB)水平显著高于PHH移植组(第1/7天分别为26和32 µg/mL,图5C)。该组肝损伤标志物(ALT、AST等)在7天内恢复至正常水平(图5D),H&E及TUNEL染色显示肝组织坏死、充血及凋亡减少,Masson等染色证实纤维化显著缓解(图5E)。
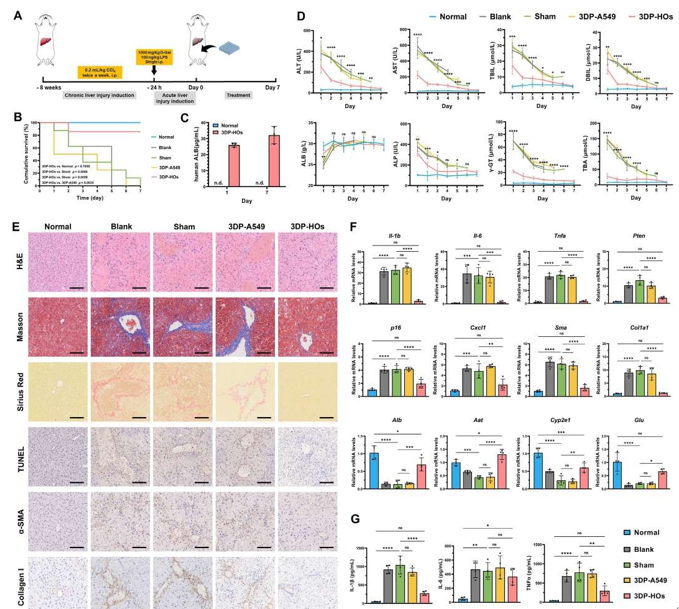
图 5. 3DP-HOs植入挽救CCl₄诱导的慢加急性肝衰竭(ACLF)模型小鼠。
2.5 3DP-HOs移植挽救Fah−/−肝衰竭小鼠
将3DP-HOs植入模拟人类I型酪氨酸血症的Fah−/−肝衰竭小鼠模型(图6A)。治疗60天后,3DP-HOs组生存率达80%,显著高于假手术组、空白组及3DP-A549组(均无存活),且体重恢复趋势与正常对照组相似(图6B-C)。移植后30天和60天血清中持续检测到人ALB(图6D),且分泌水平随时间递增,提示3DP-HOs内肝细胞可能在体内微环境中增殖或功能增强。该组肝损伤标志物(ALT、AST等)显著降低(图6E),H&E及TUNEL染色显示肝组织坏死、凋亡减少,Ki67染色证实细胞增殖活跃(图6F)。基因分析表明,3DP-HOs组炎症/纤维化相关基因(如Il-1β、Trp53)表达显著下调,肝功能基因(Alb、Cyp2e1)及增殖基因Mki67上调,部分指标与正常组无差异(图6G)。尽管血清IL-1β、IL-6和TNF-α水平较假手术组显著下降,但仍高于正常组,提示残留炎症(图6H)。
进一步评估 3DP - HOs - C2/C19。结果显示,结果显示其移植组生存率显著提高,血清hALB持续分泌,肝损伤标志物降低。组织学分析证实其促进肝再生、减少凋亡及炎症。3DP - HOs - C1、C2、C19 在两种肝衰竭小鼠模型中验证了治疗效果,突显其广泛适用性及体内治疗的巨大潜力。
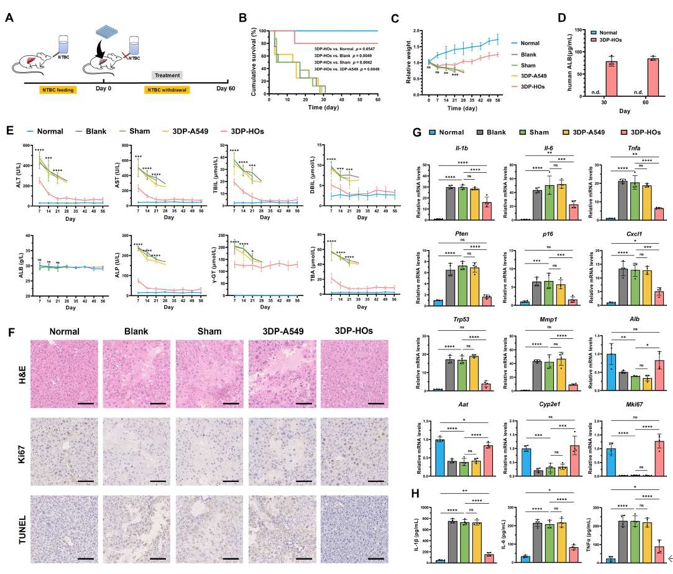
图 6. 3D生物打印肝类器官(3DP-HOs)移植挽救Fah基因敲除(Fah−/−)肝衰竭小鼠。
2.6 3DP-HOs促进血管生成并维持高细胞活性功能治疗Fah−/−肝衰竭小鼠
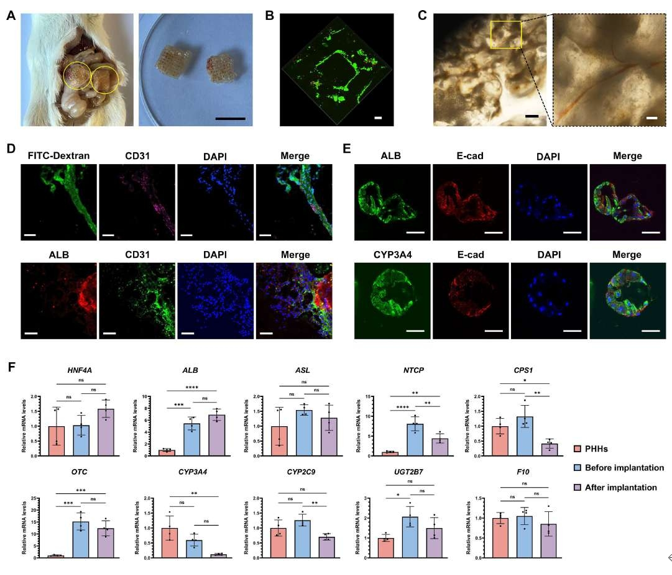
图 7. 3DP-HOs促进血管化并维持高细胞活性治疗Fah−/−肝衰竭小鼠
三、讨论
本研究采用基于hCiPSCs的肝类器官(hCiPSC-HOs)结合球体生物打印技术构建功能性肝组织模型(3DP-HOs)。通过PDMS基透气微孔装置增强氧供,实现大规模高活性hCiPSC-HOs制备。与传统方法(如直接肝细胞移植易引发免疫排斥,微囊化移植受限于氧扩散不足)相比,3DP-HOs利用GelMA水凝胶构建网格结构,其互连微通道促进氧/营养传输,显著提高细胞存活率,且植入60天后仍保持完整结构(图7A),可安全取出。RNA测序显示,3DP-HOs在打印前后基因表达谱高度一致(图4A-B),虽较原代肝细胞(PHHs)存在药物代谢(如细胞色素P450活性)及免疫功能差距,但其成熟度显著优于hCiPSC-Heps(图4)。
在CCl4诱导的ACLF及Fah−/−酪氨酸血症小鼠模型中,3DP-HOs均显著提高生存率,降低肝损伤标志物及炎症因子(IL-1β、TNF-α),并缓解纤维化(图5-6)。长期治疗中,3DP-HOs促进肝再生(Ki67表达上调),且通过宿主血管网络实现氧/营养供给及代谢物清除(图7C-D)。组织学证实其结构内形成功能性血管(CD31),并与肝细胞(ALB)紧密互作(图7D)。
未来研究需优化生物墨水:天然水凝胶(如海藻酸、胶原)虽具生物相容性但力学性能不足;合成水凝胶(如PEG)可调控力学但缺乏生物活性。开发合成-天然杂化墨水或动态交联策略有望平衡性能。规模化应用需解决细胞量(约5×109个)及氧供难题,结合氧释放材料(CaO2纳米颗粒)及灌注生物反应器或可突破限制,推动功能性肝组织模型的临床转化。
四、结论
3DP-HOS与使用基于单核的生物打印制造的模型相比,显示出增强的细胞活力,并表现出与HCIPSC-HOS相似的基因剖面,同时保持乳胶特异性功能。此外,3DP-HOS植入可显着提高CCL4诱导的急性智力肝衰竭的小鼠的存活率,以及肝衰竭的Fah−/− 小鼠。 3DP-HOS显着降低了肝损伤,炎症和纤维化指数,同时促进肝脏再生和生物功能表达。我们的生物打印肝组织模型对肝衰竭具有显着的治疗功效,并具有在肝脏再生医学领域进行临床研究的巨大潜力。
五、参考文献
